Top
Top加速する細胞治療・遺伝子治療の進化
「手作業」が支える現場の課題
再生医療や細胞治療・遺伝子治療は、2010年代以降、欧米、韓国、中国、日本を中心に急速に研究が進められてきました。心筋や表皮などの細胞を用いた「再生医療」の実用化の例として、2016年、テルモは世界初の重症心不全治療用の再生医療等製品である、ヒト(自己)骨格筋由来細胞シートを発売しています。その一方で、がんの患者さんなどに向けた「細胞治療」や「遺伝子治療」も、今後の医療における新しい領域として成長し続けています。
白血病の新たな治療法として承認されたCAR-T細胞治療*1のように、患者さん自身の血液から採取したT細胞にCAR遺伝子と呼ばれる遺伝子を導入した後に体内に戻す自己免疫療法や、ドナーの骨髄などに含まれる間葉系幹細胞を培養して患者さんに移植する治療(MSC:mesenchymal stem cell therapy)は、細胞治療の代表例です。また、この間葉系幹細胞を使う治療は、肺、脊髄、軟骨を含むさまざまな臓器損傷の治療を目的とした臨床試験で有効性が示されている他、中枢神経系や血管系などの治療が困難な疾患や、COVID-19の急性呼吸窮迫症候群(ARDS)のような新たに出現した疾患も、この治療法の臨床試験の候補となっています。
*1
CAR-T細胞治療…自己免疫療法の一つ。患者さんの血液から、がん細胞とたたかう免疫細胞「T細胞」を採取し、がん細胞を見分けるキメラ抗原受容体T細胞(Chimeric Antigen Receptor T-cell)へと遺伝子を組み替え、患者さんに投与する治療法
細胞治療や遺伝子治療で用いる細胞製剤の研究開発は、主に製薬企業やバイオベンチャー、大学などで進められています。しかしこれらの分野はまだ発展途中にあることなどから、細胞処理や製剤化のプロセスは通常、膨大な量の作業を手作業で行われることが少なくありません。細胞に遺伝子を導入する、治療に必要な細胞数まで細胞を培養拡大する、細胞製剤としてバッグに充填・仕上げるといった作業に加え、製造販売承認を得るため規制(GMP)に沿ったデータを記録し文書化するなど、膨大な業務が人の手によって行われています。また、細胞培養用のフラスコや培地、クリーンルームといった設備費用や人件費、時間を必要とします。さらに、作業中の汚染リスクへの配慮や、細菌の侵入リスクへの配慮など、現場では多くの課題を抱えています。
製造プロセスの自動化で
細胞治療の研究・創出の現場に貢献
テルモの3つのカンパニーの1つ、米国コロラドに本拠地を置く、血液・細胞テクノロジーカンパニー(Terumo Blood and Cell Technologies)は、複雑なプロセスを自動化・標準化するという技術的な強みを持ち、その技術や専門知識を細胞治療や遺伝子治療の分野に持ち込んできました。長年にわたり、そのコア技術である血液および細胞処理技術の開発・改良・技術革新に取り組み続けています。
中でも特筆すべき技術は、アフェレシス治療にまつわる遠心分離技術です。アフェレシスとは、ドナーや患者さんの血液から特定の成分のみを採取し、それ以外の成分をドナーや患者さんに再び戻す治療です。Terumo Blood and Cell Technologiesの遠心型血液成分分離装置においては、血液から特定の細胞を選択的・効率的に採取する技術を追求してきました。これらの細胞は、CAR-T細胞治療などの遺伝子改変細胞治療に用いる細胞治療薬の生物学的原料として製剤プロセスのスタートを担っています。
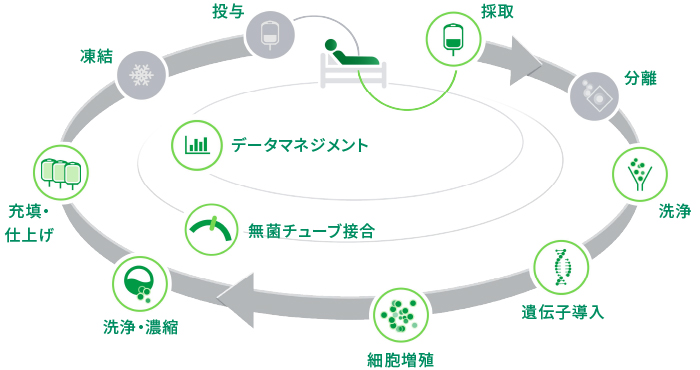
細胞治療のサイクル(イメージ)
病院での細胞採取、製薬会社などでの細胞製品の製造、細胞製品のバッグへの充填・仕上げ、製品の凍結、患者への投与のための病院への凍結製品の輸送が含まれます(治療によりプロセスは異なります)
Terumo Blood and Cell Technologiesは、患者さんの血液から必要な細胞を採取する「遠心型血液成分分離装置」、治療に必要な細胞を必要な量に培養増殖させるための「細胞増殖システム」、それらの細胞を洗浄・濃縮する「細胞処理装置」、患者さんに届けられる形にするためバッグに充填し製剤化する「充填・仕上げシステム」を中心に、製造プロセスの中でモジュール式の製品を提供しています。この他、各段階で使用される無菌接合装置や、細胞処理工程を自動的に記録・文書化するデータ管理システムも提供しています。細胞採取から細胞製剤として患者さんの治療に至るまでのワークフローを効率化するシステムを提供することで、手作業の多い細胞治療薬の研究・創出の現場に貢献することを目指しています。
独自の細胞処理テクノロジーで
効率的かつ安定した細胞培養へ
細胞を製造する上で、とりわけ重要なプロセスは「細胞増殖」(cell expansion)です。Terumo Blood and Cell Technologiesのもつ血液・細胞の技術と知見が生かされた細胞増殖システムは、細胞の空気接触のない閉鎖系の滅菌済みディスポーザブル細胞培養セットを搭載しています。手作業のために手間やエラーが発生しやすい、細胞への給餌、老廃物の除去、酸素の供給、二酸化炭素の除去などの重要なプロセスの自動化を可能にし、細胞の品質を維持したまま、手作業と比べて飛躍的に効率的かつ安定的な培養(細胞増殖)の実現を目指しています。

細胞増殖システム
血液透析事業で培ったホローファイバー(中空糸)技術
細胞増殖システムの心臓部にあたる、バイオリアクターには血液透析で用いる、ホローファイバー(中空糸)半透膜の技術を使用しています。1本のバイオリアクターには約11,500本のホローファイバーが用いられ、細胞を含んだ溶液をファイバー内部で連続的に還流させながら細胞を増殖させます。
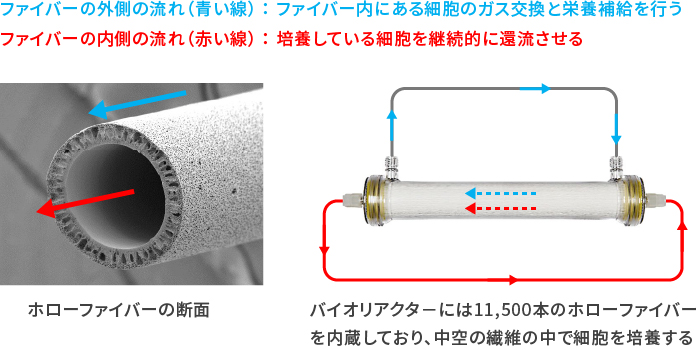
このホローファイバーが作り出す約21,000㎡の細胞培養面積は、手作業で用いる細胞培養用の175Tフラスコおよそ120個分の表面積に相当します。ホローファイバー技術を用いることで、小さなスペース内で膨大な細胞増殖が可能となり、また、省スペース化も実現しています。

科学と工学の連携で、課題だった浮遊細胞の培養を実現
細胞には、固体に接着して増殖する「接着細胞(adherent cells)」と、液体内を浮遊しながら増殖する「浮遊細胞(suspension cells)」があります。間葉系幹細胞(MSC)のような接着細胞の場合は、細胞をホロ―ファイバーの内壁に付着させて増殖・拡大させます。しかし、浮遊細胞の場合は、ファイバー内に接着させて増殖させることができないことが初期モデルの細胞増殖システムの課題となっていました。社内で科学者とエンジニアが連携しながら研究を重ねた結果、バイオリアクターの両端から培養液を流すことにより浮遊細胞をバイオリアクター内に留めながら培養する技術を生み出しました。ファイバーの繊維壁の透過性が非常に高く、細胞を内側に留めながらも、培養液はファイバーの外に逃すことができたのです。これによって、1mLあたり2億個の細胞培養密度を維持することができ、従来の手作業による細胞培養の10倍から数百倍に向上しています。この技術改良で、Terumo Blood and Cell Technologiesの細胞増殖システムは、接着細胞と浮遊細胞、両方で同じバイオリアクターの使用が可能となり、特許も取得しています。

最終製剤化ステップを自動化する 革新的な技術
細胞治療薬の最終製剤化と凍結保存もまた、非常に重要なステップです。この段階では高額なコストを要する製造工程に入ると同時に、治療を待っている患者さんが目前にいる状態で、この段階で失敗することは致命的です。この最後の「充填と仕上げ」においては、細胞の無菌性、機能性、生存性を維持することが、すべてにおいて重要です。プロセスの初期の工程は自動化が適用されることが多いものの、この最終工程については特に手作業に依存し続けていることが多く、解凍や患者さんへの輸血の時点での細胞の生存性と機能性に影響を与える可能性が課題となっていました。
Terumo Blood and Cell Technologiesの充填・仕上げシステムは、最終的な製剤化と充填工程を自動化して制御するように設計されています。その柔軟性と電子データの自動記録により、プロセス管理が強化され、バイオ医薬品などの製造方法にかかわる現行医薬品適正製造基準(cGMP)への準拠も容易になります。

充填・仕上げシステム
長年培ってきた技術の継承で切りひらく
細胞治療の新たな可能性
現在、加速的に成長している細胞治療や遺伝子治療の分野は、Terumo Blood and Cell Technologiesが長年培ってきた技術とノウハウを生かし、同社の細胞処理製品ポートフォリオを強化することを通じて、医療の質をさらに向上させる新たな可能性を秘めています。今後もさらにニーズが高まる細胞治療分野に貢献していきます。