
News release
テルモのニュースリリースは、当社企業活動をステークホルダーの皆様にお伝えするためのものです。医療機器や医薬品の情報が含まれることがありますが、これらは報道関係者、株主・投資家等の皆様を対象にした情報であり、顧客誘引や医学的アドバイスを目的とするものではありません。
薬剤充填用注射器「PLAJEX」の欧州展開に寄与
 Top
Topテルモ株式会社(本社:東京都渋谷区、社長:佐藤 慎次郎)の100%子会社であるテルモ山口D&D株式会社の本社工場は、7月2日、欧州医薬品庁(EMA)から薬剤充填済み注射器の製造に関してGMP(Good Manufacturing Practice)適合の認定を取得しました。
GMPとは医薬品の製造管理と品質管理に関する基準のことです。各国の規制当局は、製造所に対して、その製造管理手法がGMPに適合し、適切な品質のものが製造される体制であるかどうかを調査し、認定をします。
今回の欧州医薬品庁の認定により、欧州で販売される薬剤充填済み注射器の製造体制が認められたことになります。
テルモ山口D&Dでは、医薬品と医療機器を組み合わせた製品であるドラッグ&デバイス製品を生産しています。今後は、「アダリムマブ」バイオシミラー(開発番号:FKB327、先発薬:ヒュミラⓇ)※1などの製剤の受託製造などをする予定です。
このバイオシミラーに関して、2017年5月に欧州医薬品庁が協和キリン富士フイルムバイオロジクス株式会社の販売承認申請を受理しており、2018年7月27日に欧州医薬品庁の医薬品評価委員会(CHMP)が、承認を推奨する旨の見解を発表しました。今後、欧州委員会の手続きを経て、10月頃に承認される見込みです。
また、本剤には、テルモの薬剤充填用注射器「PLAJEX」が容器として採用されています。PLAJEXは、バイオ医薬品にも対応できるように開発された、プラスチック製の薬剤充填用注射器です。シリコーンオイル不使用、オートクレーブ滅菌といったバイオ医薬品の凝集や酸化などのリスク低減を目指した設計・製法が特徴です。※2
テルモは今後も、薬剤充填用注射器の素材技術や無菌充填技術などを活かし、製薬企業とのアライアンス事業を拡大してまいります。
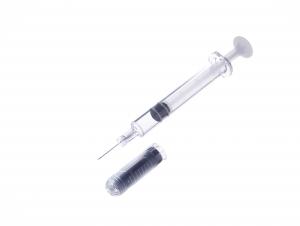
薬剤充填用注射器「PLAJEX」
※1
本バイオシミラーは、医薬品と医療機器を組み合わせたコンビネーション製品として、テルモと協和キリン富士フイルムバイオロジクス株式会社等が共同で開発を進めてまいりました。先発医薬品のヒュミラは米国アッヴィ社の製品で、2017年に全世界で184億ドルの売上高を記録し、世界で最も販売されているバイオ医薬品です。ヒュミラの登録商標はアッヴィバイオテクノロジーリミテッドが有しています。
※2
シリコーンオイルは、薬剤充填用注射器の滑らかな摺動性を確保するための潤滑剤として古くから用いられるものの、バイオ医薬品に含まれるたんぱく質の凝集を誘起する事例が報告されています。そこで、PLAJEXは、シリコーンオイルを使わなくても、安定的かつ滑らかな摺動性を発揮するテルモ独自のi-coatingを採用しています。
また、滅菌法によっては、注射器内にラジカル(不対電子を持つ原子、分子、イオン)が発生することが知られており、バイオ医薬品酸化の要因の一つとして、注射器内に発生し残存したラジカルの関与が推察されています。オートクレーブ滅菌は、ラジカルを積極的に発生させないため、バイオ医薬品の酸化リスクを低減できる滅菌法として、PLAJEXに採用されています。
テルモは、「医療を通じて社会に貢献する」という理念を掲げ、100年の歴史を持つ医療機器メーカーです。日本に本社を構え、世界160以上の国と地域で事業を展開、30,000人以上のアソシエイト(社員)が革新的なソリューションを届けるために日々働いています。
国産体温計の製造に始まり、設立以来、医療の基盤を支え続けてきました。現在は、カテーテル治療、心臓外科手術、薬剤投与、糖尿病管理、腹膜透析、輸血や細胞治療などに関する幅広い製品・サービスを提供しています。
テルモは、患者さんや医療従事者をはじめ、広く社会にとって価値ある企業を目指します。