
News release
テルモのニュースリリースは、当社企業活動をステークホルダーの皆様にお伝えするためのものです。医療機器や医薬品の情報が含まれることがありますが、これらは報道関係者、株主・投資家等の皆様を対象にした情報であり、顧客誘引や医学的アドバイスを目的とするものではありません。
欧日に続き、製造受託するバイオシミラー「Hulio」に関するGMP適合を取得
 Top
Top
テルモ株式会社(本社:東京都渋谷区、社長:佐藤 慎次郎)の100%子会社であるテルモ山口D&D株式会社(山口県山口市)は、製造を受託するバイオシミラー*に関して、米国の食品医薬品局(FDA)からGMP(Good Manufacturing Practice)適合を取得しました。
このたびのGMP適合は、協和キリン富士フイルムバイオロジクス株式会社が7月9日に米国での販売承認取得を発表した、バイオシミラー「Hulio®」(先発医薬品:アッヴィ社のバイオ医薬品「ヒュミラ」)が対象です。医薬品の承認を取得するにあたっては、製造所は製造管理手法と品質管理体制についての調査を受け、販売先国の規制当局からGMP適合の認定を取得する必要があります。
本製品は、関節リウマチや尋常性乾癬の治療に用いられます。協和キリン富士フイルムバイオロジクス社は、2018年にマイラン社と提携し、同社が現在欧州各国で販売をしています。続いて、2020年6月には日本での製造販売承認も取得し(製品名:アダリムマブBS皮下注「FKB」)、今回の承認を機に米国では2023年の発売を見込み、グローバル展開を加速させます。
Hulioは、テルモが開発したプラスチック製の薬剤充填用注射器「PLAJEX」に薬剤が充填されています。タンパク質を有効成分とするバイオ医薬品は、不純物や温度、光などの影響を受けやすく、取り扱いが容易ではありません。PLAJEXは、薬剤の吸着や不純物の溶出を起こしにくいテルモ独自開発の素材を使用していて、バイオ医薬品との相性に配慮しています。現在、複数の医薬品の充填容器として採用されていますが、PLAJEXを使用した製品が米国市場で承認されるのは初めてです。
テルモは引き続き、製薬企業のニーズに応える開発製造受託(CDMO)ビジネスを拡大し、より良い医療の普及に努めてまいります。

PLAJEXの生産工程
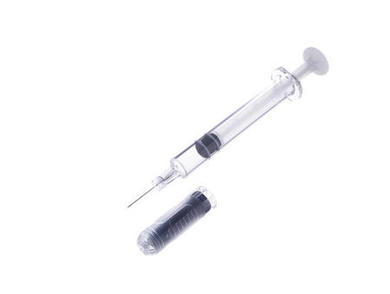
薬剤充填用注射器PLAJEX
バイオシミラー(バイオ後続品)とは、既に承認されたバイオ医薬品と同等・同質の品質、安全性および有効性が認められた製品です。バイオ医薬品の有効成分は分子量が大きく構造が複雑なため、バイオシミラーの開発においては同等性・同質性を示すために新薬と同様に多くの試験が行われます。
テルモのテクノロジー「#03 患者さんに必要な薬を安全・確実に届ける技術」
テルモは、「医療を通じて社会に貢献する」という理念を掲げ、100年の歴史を持つ医療機器メーカーです。日本に本社を構え、世界160以上の国と地域で事業を展開、30,000人以上のアソシエイト(社員)が革新的なソリューションを届けるために日々働いています。
国産体温計の製造に始まり、設立以来、医療の基盤を支え続けてきました。現在は、カテーテル治療、心臓外科手術、薬剤投与、糖尿病管理、腹膜透析、輸血や細胞治療などに関する幅広い製品・サービスを提供しています。
テルモは、患者さんや医療従事者をはじめ、広く社会にとって価値ある企業を目指します。